 联系我们
联系我们
 18210828691
18210828691
【医疗器械UDI】CFDA医疗器械唯一标识UDI申请指南(基于GS1标准)
一、医疗器械唯一标识UDI简介
医疗器械唯一标识(Unique Device Identification,简称UDI)是医疗器械产品的电子身份证。UDI由产品标识(DI和生产标识(PI)组成,产品标识(DI)可以标识具体的产品名称、型号规格、包装规格等信息;生产标识(PI)可以标识序列号、生产批号、生产日期等信息。
UDI=DI+PI
二、UDI砝码机构
目前经过NMPA批准使用的发码机构一共有三个,分别是:
中国物品编码中心(基于GS1标准)
中关村工信二维码技术研究院(MA码,基于IDcode编码体系)
阿里健康科技(中国)有限公司(基于AIM规则)。
三、基于GS1标准实现UDI及简介
GS1即国际物品编码协会,基于GS1标准的唯一器械标识(UDI)是完全可以实现医疗器械可追溯,并且在全球范围更加有利于实现信息共享与交换。
UDI代码结构:UDI=DI+PI
基于GS1标准的UDI代码结构=GTIN+AI
GTIN为全球贸易项目代码(相当于DI功能)
AI为应用标识符(相当于PI功能),可以选取有效期、批号、序列号、生产日期等,为可选项)
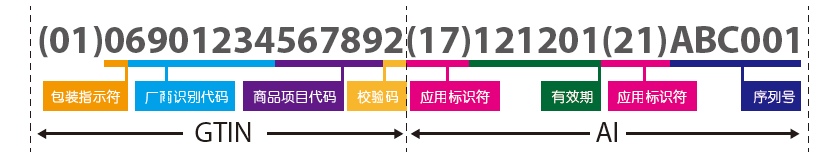
厂商识别代码由7~10位数字组成,中国物品编码中心负责分配和管理。厂商识别代码的前3位代码为前缀码,国际物品编码协会已分配给中国物品编码中心的前缀码为690~699;商品项目代码由厂商识别代码所有人(即商品条码系统成员)依据有关国家标准自行分配;校验码由标准算法得出。
四、GS1-UDI的数据载体
1.直接贴于产品上的UDI
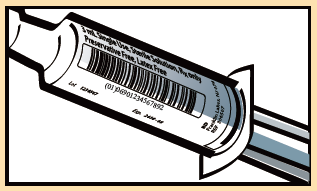
2. 销售包装上的UDI

3.箱包装上的UDI

五、条码打印设备
采用标签打印机,如SATO佐藤中国LCS解决方案,可实现条码清晰打印。
六、医疗器械UDI申请流程(基于GS1)?
1.准备厂商申请资料
a.营业执照副本盖章扫描件
b.系统填写中国商品条码系统成员注册登记表
2.汇款缴费
向中国物品编码中心指定账户进行缴费。
3.中国物品编码中心各地分中心审核
4.中国物品编码中心总中心审核
5.审核通过,下发厂商证书及密码卡
6.携带申请资料,到分中心领取厂商证书及密码卡
7.系统登录与密码卡激活
8.填写UDI条码信息
9.制作条码(内置1000个条码)
10.在产品包装、运输单元上印刷使用条码
11.条形码申请时间为10-15个工作日左右申请完毕,根据地区不同有快有慢。
七、注意事项
1.条形码系统使用期限2年。
2.条形码系统2年到期需要提前年审,提前3个月办理续展。
八、咨询方式:
参见各办理地政务服务网或主管部门公开联系方式。
九、联系美临达:
美临达医疗(www.medlinda.com)
联系方式:18210828691(微信同)
美临达医疗,专注于医疗器械等领域法规咨询。
核心团队:来自生产企业、CRO或咨询公司,有多年医疗器械等领域咨询管理经验,可为客户打造高效快捷、优质的咨询服务。
战略目标:基于专注的服务精神,公司致力于成为国内优质的医疗器械等领域法规咨询服务供应商,为国内外客户及自身创造双赢的良好发展前景。
以上内容来自第三方机构或网站,由美临达医疗理发布。仅用于知识分享,不作为广告用途,如有不当或侵权,请联系美临达修改或删除。
相关阅读: