 联系我们
联系我们
 18210828691
18210828691
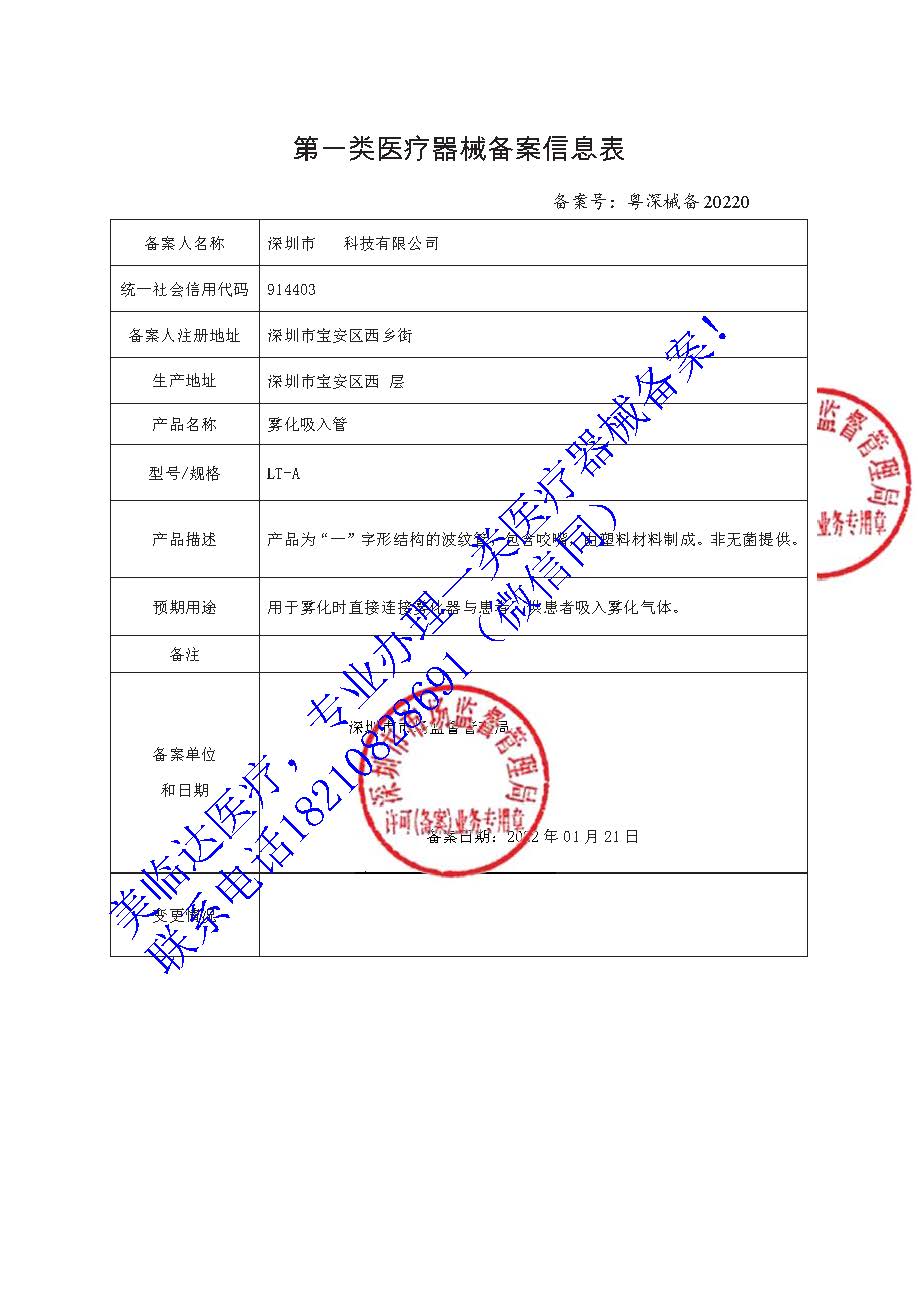
【深圳】第一类医疗器械产品备案凭证【雾化吸入器】
美临达医疗,专业办理第一类医疗器械备案,联系方式:18210828691(微信同)
【摘要】
【深圳】地区第一类医疗器械产品,根据《医疗器械监督管理条例》,实行备案制,需到所在地市(区)级药品(市场)监督管理局办理备案,方可生产销售。
美临达医疗,接受【深圳】客户委托,办理【雾化吸入器】第一类医疗器械备案,双方确认可行性后,签订《咨询服务合同》。美临达安排了经验丰富的注册专员,顺利协助客户取得第一类医疗器械备案凭证!
下面小编就给大家介绍一下雾化吸入器的办理过程!
【正文】
1.整理【雾化吸入器】基本信息
产品名称:雾化吸入器
产品描述:通常为“一”字形结构的波纹管或软管,也可包含咬嘴,一般采用塑料或硅橡胶材料制成。非无菌产品。
预期用途:用于雾化时连接雾化器与雾化面罩或咬嘴,含有咬嘴的直接连接雾化器与患者,供患者吸入雾化气体;或用于连接气源与雾化装置。
2.准备【雾化吸入器】备案资料
注册专员根据法规整理了一下备案资料:
(1)第一类医疗器械备案表
(2)安全风险分析报告
(3)产品技术要求
(4)产品检验报告
(5)临床评价资料
(6)产品说明书及最小销售单元标签设计样稿
(7)生产制造信息
(8)证明性文件:营业执照
(9)符合性声明
3. 递交【雾化吸入器】备案资料
注册资料按照下面的流程提交【雾化吸入器】备案资料:
(1)资料发给客户审核
(2)资料客户签字盖章
(3)资料上传医疗器械备案系统
(4)跟进备案审批进度
(5)根据审批意见修改申请材料
(6)取得第一类医疗器械备案凭证
4. 顺利取得【雾化吸入器】备案凭证
在注册专员的协助下,美临达顺利协助【深圳】客户取得【雾化吸入器】备案凭证。

5. 期待为客户提供更多服务
|
√ |
国产第Ⅰ类医疗器械产品备案 |
√ |
医疗器械临床试验 |
|
√ |
国产第Ⅰ类医疗器械生产备案 |
√ |
第Ⅱ类医疗器械经营备案 |
|
√ |
国产第Ⅰ类医疗器械生产体系咨询 |
√ |
医疗器械分类界定 |
|
√ |
进口第Ⅰ类医疗器械产品备案 |
√ |
ISO 9001体系认证 |
|
√ |
国产第ⅡⅢ类医疗器械产品注册 |
√ |
ISO 13485体系认证 |
|
√ |
国产第ⅡⅢ类医疗器械生产许可 |
√ |
商标注册 |
|
√ |
国产第ⅡⅢ类医疗器械生产体系咨询 |
√ |
版权申请 |
|
√ |
进口第ⅡⅢ类医疗器械产品注册 |
√ |
条码申请 |
|
√ |
同品种医疗器械临床评价报告 |
√ |
医疗广告审查申请 |
更多服务介绍可登陆www.medlinda.com进行查询。
以上就本次分享的全部内容了,希望大家能有所收获~
美临达医疗,专注于医疗器械等领域法规咨询。
核心团队:来自生产企业、CRO或咨询公司,有多年医疗器械等领域咨询管理经验,可为客户打造高效快捷、优质的咨询服务。战略目标:基于专注的服务精神,公司致力于成为国内优质的医疗器械等领域法规咨询服务供应商,为国内外客户及自身创造双赢的良好发展前景。美临达医疗(www.medlinda.com)可提供:-医疗器械注册服务-医疗器械备案服务
-医疗器械生产体系咨询-化妆品备案-科研医学翻译服务联系方式:18210828691(微信同)
以上内容来自第三方机构或网站,由美临达医疗理发布。仅用于知识分享,不作为广告用途,如有不当或侵权,请联系美临达修改或删除。