 联系我们
联系我们
 18210828691
18210828691







【图文】一次性使用皮肤点刺针:生产备案资质要求全解析,守护安全医疗新防线
在现代医疗诊断与治疗中,一次性使用皮肤点刺针作为快速、准确检测过敏原的重要手段,其安全性与合规性备受关注。为了确保这一关键医疗器械的质量与安全,生产企业必须获得相应的生产备案资质。本文将为您深入解析一次性使用皮肤点刺针生产备案的资质要求,并探讨#医疗器械安全与合规生产#的热门话题。
一次性使用皮肤点刺针,作为医疗器械的一种,专门设计用于皮肤点刺试验,以检测人体对特定过敏原的反应。其一次性使用的特性有效避免了交叉感染的风险,是医疗安全的重要保障。而生产备案资质则是国家对生产企业进行监管,确保其生产条件、质量管理体系及产品安全性、有效性符合国家法规和标准的重要手段。
企业资质:生产企业需具备合法有效的营业执照,且经营范围应包含医疗器械生产或相关项目。同时,企业应获得医疗器械生产许可证(若适用),以证明其具备生产医疗器械的资质和能力。
生产条件:企业应建立符合医疗器械生产质量管理规范(如ISO 13485)的生产车间和设施,确保生产环境洁净、无污染。此外,还需配备必要的生产设备、检验仪器和人员,以保障生产过程的顺利进行和产品质量的稳定可靠。
质量管理体系:企业应建立并有效运行质量管理体系,覆盖产品设计、采购、生产、检验、销售等全过程。通过定期的内审、管理评审和纠正预防措施,持续改进质量管理体系,确保产品质量的持续提升。
产品技术要求:一次性使用皮肤点刺针应符合国家相关法规和标准的要求,具有明确的产品技术要求。这些要求包括但不限于材料的生物相容性、针尖的锋利度与强度、包装的密封性等,以确保产品的安全性和有效性。
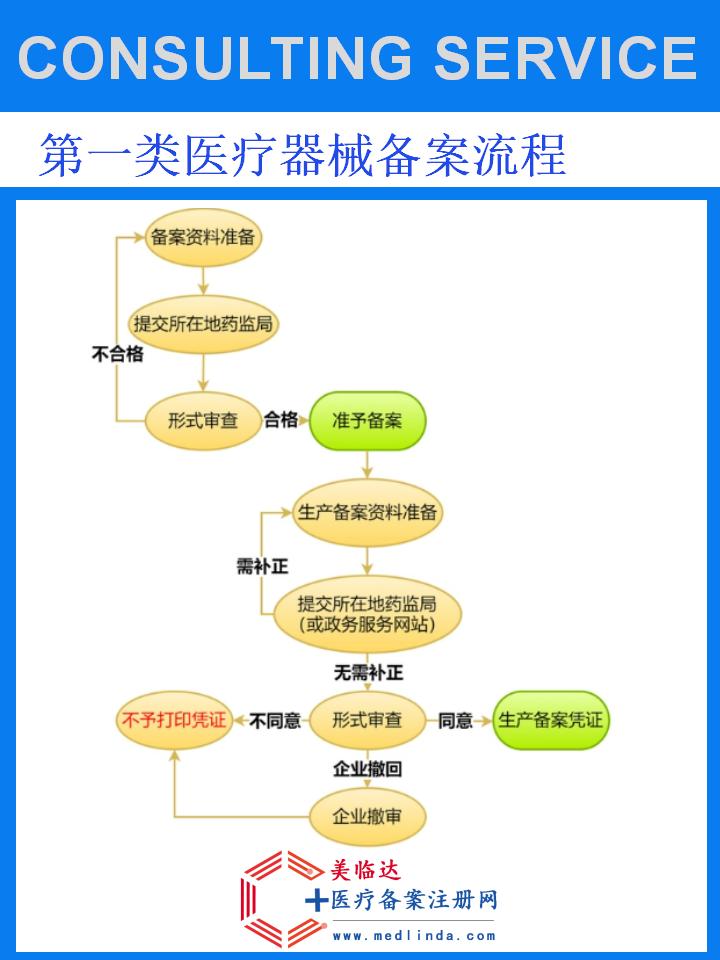
注册检验与备案:生产企业在完成产品设计和试制后,需委托具有资质的检验机构进行产品注册检验。检验合格后,方可向国家药品监督管理局或其授权的地方药品监管部门提交备案申请。申请时需提交完整的备案资料,包括企业资质证明、产品技术要求、检验报告等。
随着医疗技术的不断进步和消费者对医疗安全的日益关注,#医疗器械安全与合规生产#已成为行业内外普遍关注的热门话题。对于一次性使用皮肤点刺针等关键医疗器械而言,确保其生产过程的合规性和产品的安全性更是至关重要。因此,生产企业应积极响应国家号召,加强内部管理,提升产品质量,为医疗行业的健康发展贡献自己的力量。