






【图文】上肢固定器上市所需资质与流程:合规之路,安全前行
在#医疗健康#、#康复器械#等热门话题日益受到关注的今天,上肢固定器作为辅助上肢治疗、促进康复的重要医疗器械,其上市前的资质准备与流程遵循显得尤为重要。本文将为您详细解析上肢固定器上市所需的关键资质与流程,助您合规上市,安全前行。
定义篇:上肢固定器的角色
上肢固定器,是一种专为上肢设计的医疗器械,旨在通过固定、支撑或限制上肢的某些活动,以促进骨折愈合、软组织修复或缓解上肢疼痛等症状。它广泛应用于骨科、康复科等多个医疗领域,是上肢康复治疗中不可或缺的工具。
上市所需资质与流程
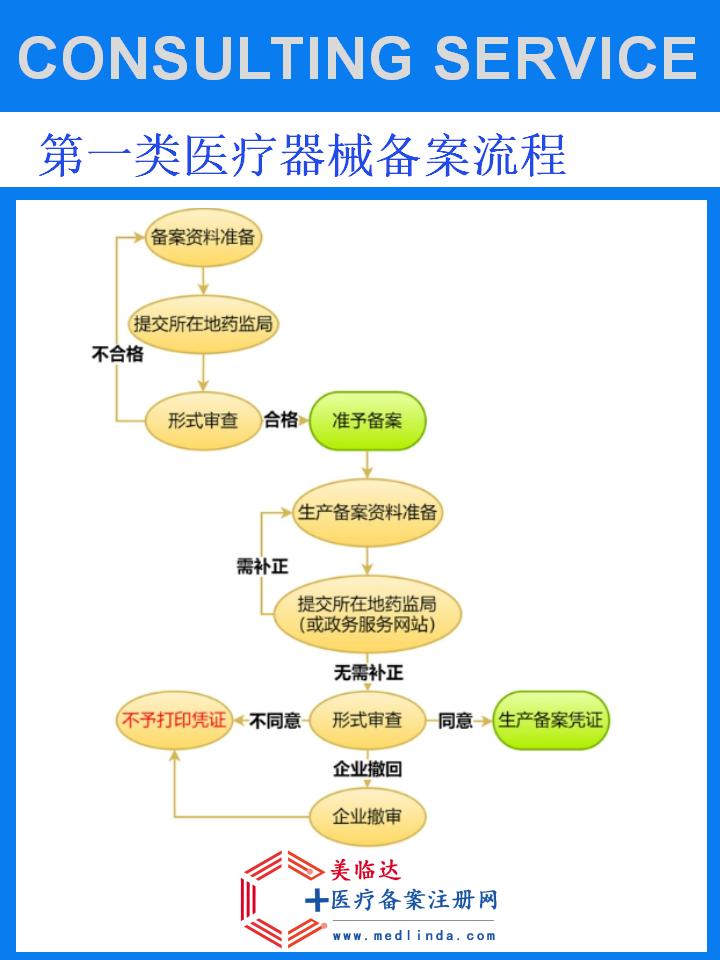
1. 资质准备
-
企业资质:生产企业需具备合法的营业执照、医疗器械生产许可证等资质,确保符合医疗器械生产企业的基本要求。
-
产品注册:在中国,上肢固定器作为医疗器械,需通过国家药品监督管理局(NMPA)的注册审批。企业需准备完整的技术文件,包括产品描述、设计原理、生产工艺、原材料来源、性能评估报告、临床试验数据(如适用)、质量管理体系文件等,提交给NMPA进行审查。
-
临床试验:对于高风险或创新性的上肢固定器,可能需要进行临床试验以验证其安全性和有效性。临床试验需遵循国家相关法规和标准,确保受试者的权益和安全。
2. 注册流程
-
提交申请:企业将准备好的注册申请文件提交给NMPA,申请文件需真实、准确、完整。
-
审查与评估:NMPA将对申请文件进行审查,评估产品的安全性、有效性和质量可控性。必要时,NMPA会进行现场检查或要求补充资料。
-
审批与发证:经审查合格后,NMPA将颁发医疗器械注册证,确认产品可以在中国市场合法销售和使用。注册证是上肢固定器上市的必要凭证,也是企业合规经营的重要保障。
3. 后续监管
-
质量管理体系:生产企业需建立并维护符合GMP标准的质量管理体系,确保产品的持续合规性和质量稳定性。
-
不良事件监测:企业需建立不良事件监测和报告制度,及时收集、分析和报告产品使用过程中出现的不良事件,确保患者安全。
-
年度报告:企业需按照规定向NMPA提交年度报告,报告产品的生产、销售、质量等情况。
结语
上肢固定器作为重要的医疗器械,其上市前的资质准备与流程遵循是确保产品安全有效、合规经营的关键。通过本文的解析,相信您对上肢固定器上市所需资质与流程有了更清晰的认识。在未来的发展中,让我们携手并进,共同推动医疗器械行业的合规发展,为更多患者带来健康与希望。
 联系我们
联系我们
 18210828691
18210828691







