 联系我们
联系我们
 18210828691
18210828691


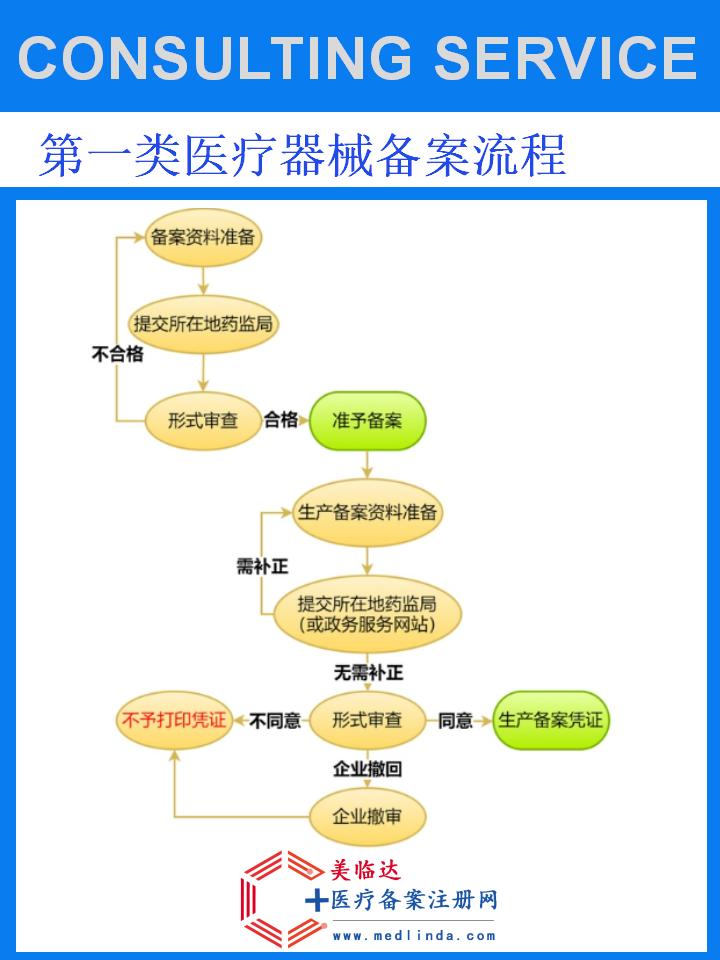





【图文】压敏胶带一类医疗器械备案流程与要求:守护医疗安全的精细步骤
在医疗护理的日常应用中,压敏胶带以其独特的粘性、柔软性和透气性,成为固定、包扎、伤口保护等场景中的不可或缺之物。#医疗器械安全# #医疗护理创新# 随着医疗技术的不断进步和监管政策的日益严格,压敏胶带作为一类医疗器械,其备案流程与要求成为企业关注的焦点。本文将为您详细解析压敏胶带一类医疗器械的备案流程与要求,助力企业合规运营,守护医疗安全。
压敏胶带一类医疗器械备案,是指生产或销售压敏胶带产品的企业,需按照《医疗器械监督管理条例》及其实施细则等相关法规,向国家药品监督管理局(NMPA)或其授权的省级药品监督管理部门提交备案申请,经过审核通过后,获得合法上市销售资格的过程。这一过程确保了压敏胶带产品的安全性、有效性和质量可控性,是保障患者使用安全的重要环节。
当前,#医疗器械合规化# 与 #患者安全保障# 是医疗行业的热门话题。压敏胶带作为一类直接接触人体并用于医疗目的的医疗器械,其备案流程的严格性和规范性直接关系到患者的使用安全和治疗效果。随着医疗技术的不断进步和监管政策的不断完善,企业需更加重视医疗器械的合规管理,确保产品质量和安全性,为患者提供更加优质、可靠的医疗服务。
压敏胶带一类医疗器械备案是企业进入市场、合法经营的必经之路。通过遵循法规、精心准备、积极配合审核,企业能够顺利获得备案凭证,为产品的市场推广和品牌建设奠定坚实基础。同时,企业也应持续关注政策变化和市场动态,加强内部管理,提升产品质量和技术创新能力,共同推动医疗器械行业的健康发展,守护每一个生命的健康与安全。