 联系我们
联系我们
 18210828691
18210828691


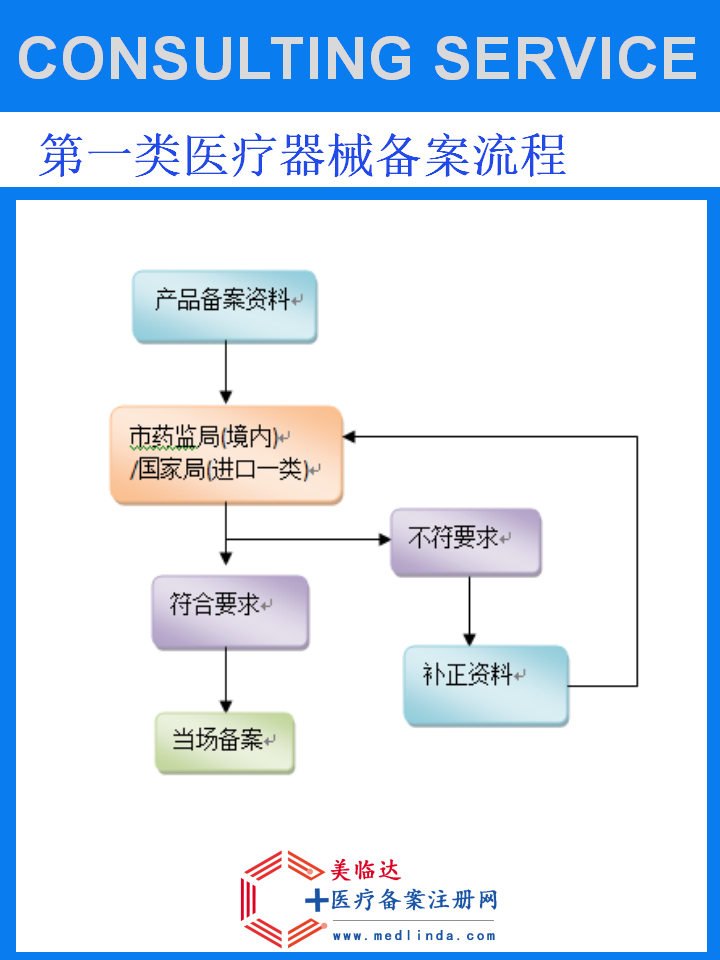


【案例】显微针进口医疗器械备案凭证办理流程:解锁医疗科技前沿的市场准入密钥
在当今快速发展的医疗科技领域,显微针作为微创医疗技术的杰出代表,以其精准、高效的特性,在肿瘤治疗、神经科学、基因疗法等多个前沿领域展现出巨大的应用潜力。随着国内外医疗市场的深度融合,显微针等高端进口医疗器械的引进成为推动国内医疗水平提升的重要力量。然而,这些高科技产品的市场准入并非易事,其中,进口医疗器械备案凭证的办理是至关重要的一环。本文将结合具体案例,深入探讨显微针进口医疗器械备案凭证的办理流程,并融入#医疗科技创新#、#进口医疗器械监管新政#等热门话题,为企业提供实用的参考与指导。
显微针作为一类高精尖的医疗器械,其设计与制造均达到了极高的技术水准,能够在极小的空间内执行复杂的医疗操作,为患者带来更加安全、有效的治疗方案。然而,由于涉及到人体健康与生命安全,国家对进口医疗器械的监管尤为严格,要求所有进入国内市场的产品必须获得相应的备案或注册凭证。因此,显微针进口医疗器械备案凭证的办理,不仅是产品合法销售的前提,更是保障患者权益、维护市场秩序的重要措施。
显微针进口医疗器械备案凭证,是指由国家药品监督管理局(NMPA)或其指定机构,依据《医疗器械监督管理条例》及相关法规,对拟进口至中国境内的显微针产品进行全面评估与审核后,颁发的允许该产品在中国境内销售的许可证明。该凭证不仅是对产品技术性能、安全性、有效性的认可,也是医疗机构采购和使用该产品的重要依据。
某国际知名医疗器械制造商,为将其最新研发的显微针产品引入中国市场,特别委托了一家专业的医疗器械咨询公司负责备案工作。在咨询公司的协助下,企业提前进行了详尽的市场调研与法规解读,确保了对备案要求的准确把握。同时,双方紧密合作,高效完成了资料准备、提交与审评过程中的各项任务。通过精准把握时间节点、积极应对审评反馈,该企业最终在短时间内成功获得了显微针进口医疗器械备案凭证,顺利打开了中国市场的大门。
显微针进口医疗器械备案凭证的办理,是一项涉及多个环节、需要多方协作的复杂工作。然而,通过科学规划、精心准备与专业合作,企业完全能够克服种种困难,实现高效办理。在这个过程中,企业不仅要关注产品本身的技术与质量,更要深入了解并遵守国家的政策法规,确保每一步操作都符合规范。同时,随着#医疗科技创新#的不断推进和#进口医疗器械监管新政#的实施,企业还需密切关注行业动态,及时调整策略,以应对日益激烈的市场竞争和监管挑战。