



【案例】进口基础外科手术器械CFDA备案凭证办事指南:合规导航,助力手术精准升级
在医疗技术日新月异的今天,基础外科手术作为医疗体系的基石,其器械的先进性与合规性直接关系到手术的安全性与效果。随着国际医疗交流的加深,进口基础外科手术器械以其卓越的性能、精湛的工艺,成为提升手术质量的重要选择。然而,这些产品要在中国市场合法销售和使用,必须跨越CFDA(现更名为NMPA,国家药品监督管理局)备案凭证这一关键门槛。本文将以实际案例为依托,结合#医疗器械合规新生态#、#外科手术技术革新#等热门话题,为有意将进口基础外科手术器械引入中国市场的企业,提供一份详尽的CFDA备案凭证办事指南,助力企业高效、顺利地完成市场准入流程。
一、引言:合规先行,精准医疗的保障
基础外科手术器械作为外科治疗的基础工具,其质量与安全直接关系到患者的生命健康。随着医疗技术的不断进步和国际化合作的加深,进口基础外科手术器械以其独特的优势,为中国的外科手术领域带来了新的机遇。然而,在中国市场,这些产品的合规性成为了不可忽视的问题。CFDA备案凭证作为产品合法销售的通行证,是企业进入中国市场必须迈过的一道坎。掌握CFDA备案凭证的办理流程与要点,对于想要在中国外科手术器械市场占据一席之地的企业来说,至关重要。
二、定义解析:进口基础外科手术器械CFDA备案凭证
进口基础外科手术器械CFDA备案凭证,是指由中国国家药品监督管理局(NMPA)颁发的,确认特定型号的进口基础外科手术器械符合中国医疗器械监管要求,允许其在中国境内销售的许可证明。这一凭证的获得,标志着产品已经通过了中国政府的严格审查,可以在中国市场上合法销售和使用,为中国的外科医生提供高质量的手术工具,推动外科手术技术的精准升级。
三、办事指南:流程、资料与策略
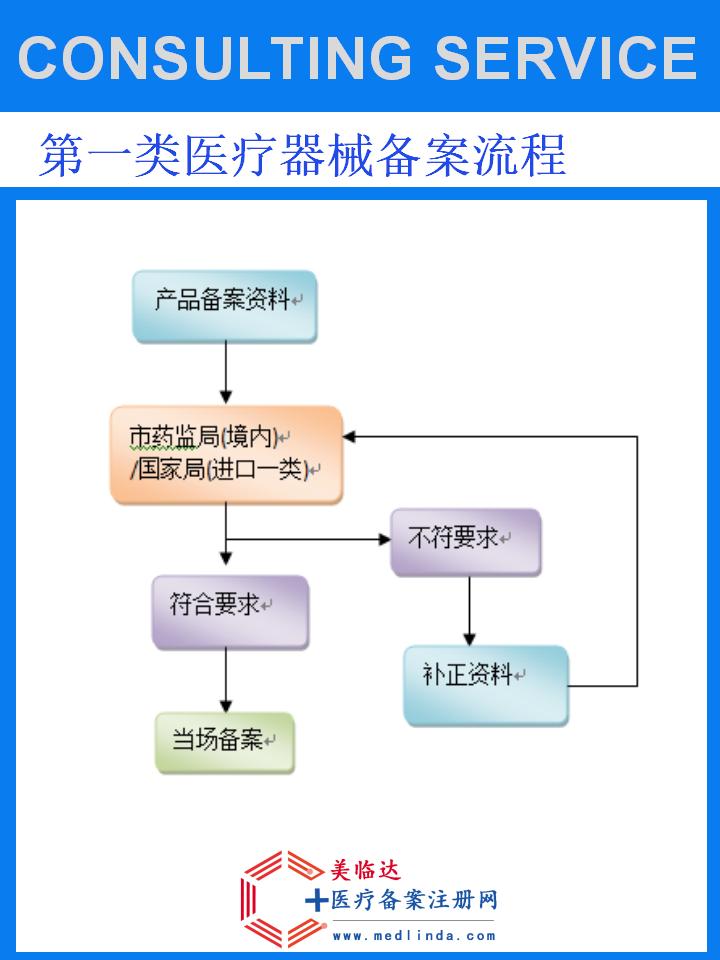
1. 办理流程概览
-
前期准备:深入研究中国医疗器械监管政策,明确产品分类与监管要求。同时,评估企业实力与产品特性,确保符合中国市场的法规框架。组建专业的团队或选择可靠的代办机构,为后续工作打下坚实基础。
-
资料准备:根据NMPA的要求,精心准备企业资质证明、产品技术资料、质量管理体系文件等关键资料。特别需要注意的是,进口医疗器械的中文标签、中文说明书等合规性文件必须准确无误,符合中国相关法规要求。
-
提交申请:通过NMPA指定的在线平台或窗口提交备案申请,并上传准备好的资料。同时,缴纳相应的备案费用,确保申请流程的顺利进行。
-
审核与评估:NMPA将对提交的申请资料进行严格的审核和评估,可能包括技术评审、现场核查等环节。企业应保持与NMPA的密切沟通,及时响应补正通知等要求,确保审核工作的顺利进行。
-
获得凭证:经NMPA审核确认无误后,颁发进口基础外科手术器械CFDA备案凭证。企业可凭此凭证在中国市场上合法销售和使用相关产品。
2. 关键资料准备
-
企业资质:包括营业执照、医疗器械经营许可证(如适用)、质量管理体系认证证书等,以证明企业的合法性和专业性。
-
产品资料:详细的产品说明书、结构图、性能参数、生产工艺流程图、产品检测报告等,以展示产品的技术特性和安全性。
-
中文合规文件:产品中文标签、中文说明书等,需确保内容准确无误,符合中国相关法规要求,便于医护人员理解和使用。
-
进口相关文件:进口合同、报关单、原产地证明、境外生产企业的注册证等,以证明产品的合法进口来源和渠道。
3. 办理策略建议
-
提前规划:鉴于CFDA备案流程的复杂性和耗时性,企业应提前规划,预留充足的时间进行准备和办理。
-
专业咨询:寻求专业的咨询机构或代办机构的帮助,可以大大提高备案的成功率和效率。这些机构通常具有丰富的经验和专业的知识,能够为企业提供全方位的指导和支持。
-
注重细节:在准备资料和提交申请的过程中,企业应注重细节,确保每一项资料都准确无误、符合法规要求。任何微小的疏忽都可能导致审核不通过或延误备案时间。
-
持续跟进:在备案过程中,企业应保持与NMPA的密切沟通,及时跟进审核进度和结果。对于可能出现的问题或补正通知,企业应迅速响应并妥善处理。
四、案例分享:实战中的智慧与经验
某国际知名医疗器械企业,在将其先进的进口基础外科手术器械引入中国市场时,选择了与一家专业的代办机构合作。代办机构凭借其丰富的经验和专业的知识,协助企业顺利完成了从前期准备、资料准备到提交申请、审核评估的全过程。在双方的共同努力下,该企业的进口基础外科手术器械成功获得了CFDA备案凭证,并迅速在中国市场站稳脚跟。这一成功案例不仅展示了代办机构的专业实力和服务水平,也为其他企业提供了宝贵的经验。
 联系我们
联系我们
 18210828691
18210828691




