 联系我们
联系我们
 18210828691
18210828691
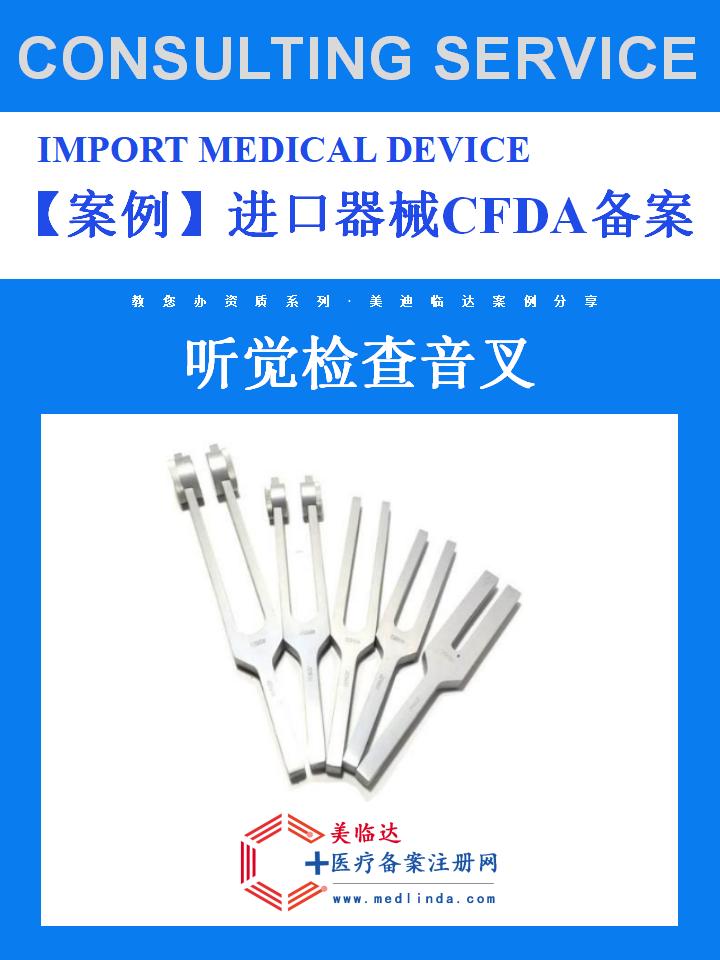




【案例】进口听觉检查音叉产品备案凭证办事指南:解锁合规入华新路径
在医疗诊断领域,听觉检查音叉作为评估患者听力状况的基本工具,其重要性不言而喻。随着国际医疗技术的交流与融合,进口听觉检查音叉以其精准的性能、多样的规格和优质的材质,逐渐成为国内医疗机构和听力检查中心的优选。然而,要想将这些优质产品顺利引入中国市场,企业必须通过严格的备案程序,获得进口听觉检查音叉产品备案凭证。本文将结合实际案例,为您详细解读进口听觉检查音叉产品备案凭证的办事指南,同时融入#热门话题,助您把握行业动态,轻松迈过合规门槛。
进口听觉检查音叉产品备案凭证,是由中国国家药品监督管理局(NMPA)或其授权的省级药品监督管理部门颁发的,确认进口第二类医疗器械(包括听觉检查音叉)符合中国相关法律法规要求,允许其在中国境内销售的许可证明。这一凭证不仅是产品合法销售的必要条件,也是保障患者用械安全、维护市场秩序的重要手段。
随着国内医疗水平的不断提升和人们对健康意识的增强,听觉检查作为预防和治疗听力疾病的重要环节,受到了越来越多的关注。进口听觉检查音叉以其精准度高、使用寿命长、操作简便等优势,满足了医疗机构和患者对高品质检查工具的需求。然而,面对复杂多变的市场环境和严格的监管要求,如何高效、合规地完成备案流程,成为进口企业面临的一大挑战。
在医疗器械行业快速发展的背景下,合规成为企业不可忽视的重要环节。当前,#医疗器械唯一标识(UDI)系统实施#、#医疗器械网络销售监管加强#等热门话题备受关注。这些新趋势不仅要求企业加强内部管理,提升产品质量,还促使企业积极适应数字化转型,实现产品全生命周期的追溯和管理。对于进口听觉检查音叉企业而言,把握这些新趋势,将有助于其在激烈的市场竞争中脱颖而出,赢得更多市场份额。
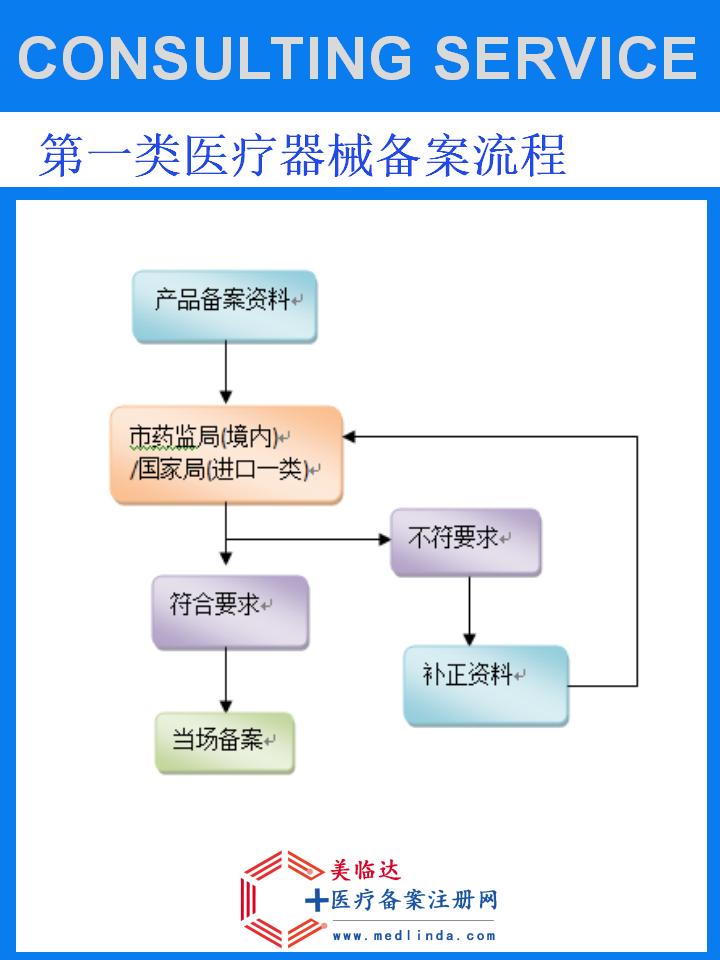
总之,进口听觉检查音叉产品备案凭证的办理是一个复杂而细致的过程,需要企业具备高度的专业性和耐心。通过本文的解析和指导,相信您已经对备案流程有了更清晰的认识和把握。希望您能够顺利获得备案凭证,开启在中国市场的新篇章。