



【案例】从国外进口骨科手术器械产品备案凭证办事指南:精准医疗的坚实后盾
在医疗技术日新月异的今天,骨科手术作为外科领域的重要分支,其手术器械的革新与发展直接关系到手术效果与患者康复质量。随着国际医疗交流的加深,国外先进的骨科手术器械产品逐渐进入国内市场的视野,为骨科医疗领域带来了新的治疗选择与可能性。然而,将这些高科技产品合法引入并销售于中国市场,获取进口骨科手术器械产品备案凭证是不可或缺的关键步骤。本文将以实际案例为蓝本,为您提供一份详尽的从国外进口骨科手术器械产品备案凭证的办事指南,并融入#热门话题,探讨在精准医疗背景下,进口骨科手术器械如何助力医疗技术的进步与发展。
一、定义解析:进口骨科手术器械产品备案凭证的意义
进口骨科手术器械产品备案凭证,是由中国国家药品监督管理局(NMPA)或其授权机构颁发的,确认进口骨科手术器械产品符合中国相关法律法规、医疗器械注册管理要求及安全有效性标准,允许其在中国境内销售的行政许可证明。这一凭证不仅是产品合法销售的“金钥匙”,更是保障患者安全、提升医疗服务质量、推动骨科医疗技术发展的重要保障。
二、案例背景:精准医疗时代的骨科手术器械革新
随着精准医疗理念的深入人心,骨科手术也向着更加精细化、个性化的方向发展。国外先进的骨科手术器械,如智能导航系统、高精度切割工具、微创手术器械等,以其独特的技术优势和卓越的临床效果,为骨科手术提供了更多可能性。这些产品的引入,不仅提升了手术精度,缩短了恢复时间,还减少了手术并发症,极大地改善了患者的生活质量。然而,进口骨科手术器械的合规之路并不简单,需要经历复杂的注册备案流程,以确保产品符合中国市场的监管要求。
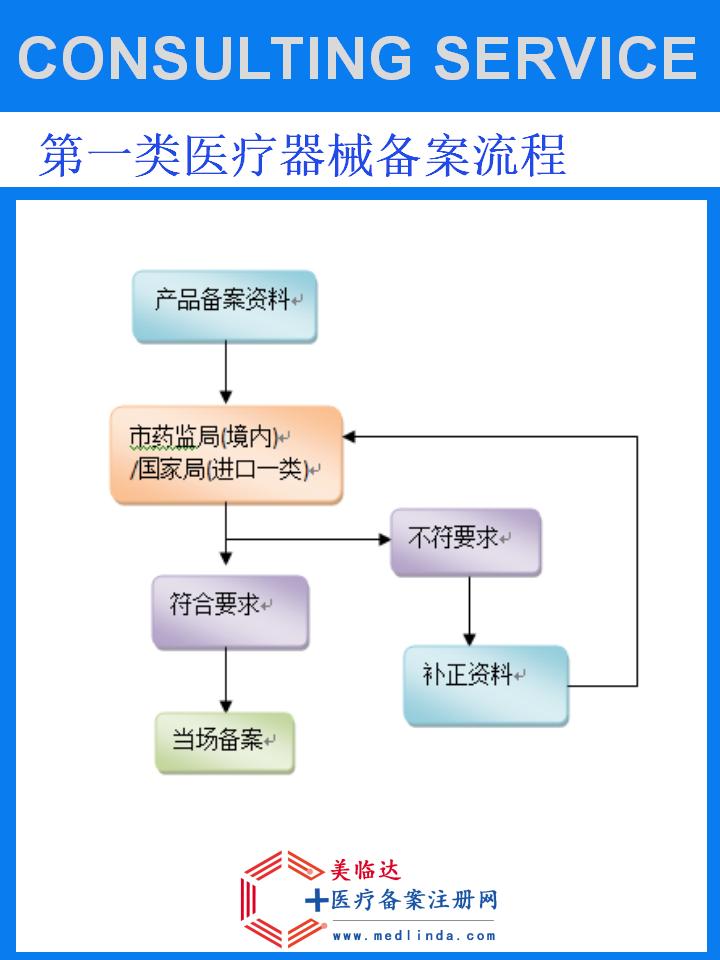
三、办事流程详解
1. 前期准备阶段
-
市场调研:了解国内骨科手术器械市场需求、竞争格局及政策导向。
-
产品评估:确认进口产品符合中国医疗器械注册管理要求及安全有效性标准,评估其技术先进性、适用性及市场潜力。
-
资料收集:全面收集产品注册所需资料,包括但不限于产品说明书、技术规格书、生产工艺流程、原材料证明、检验报告、临床试验数据(如适用)、生产国(地区)上市证明等。
2. 提交申请阶段
-
选择受理机构:确定向NMPA或其指定的审评机构提交注册申请。
-
在线申报:通过官方指定的医疗器械注册管理系统提交电子申请资料。
-
资料预审:受理机构对提交的资料进行初步审查,确保资料齐全、规范。
3. 技术审评与现场核查
-
技术审评:受理机构组织专家团队对产品的技术性能、安全性能及符合性进行深入审评。
-
现场核查(如必要):根据审评需要,可能要求对产品生产现场或境内代理人/经销商进行现场核查。
4. 审批发证阶段
-
审批决定:基于技术审评和现场核查结果(如适用),受理机构作出是否予以注册的决定。
-
颁发凭证:对于通过审评的产品,颁发《医疗器械注册证》及《医疗器械生产/经营备案凭证》(如适用)。
四、所需资料清单
-
申请人资质证明:营业执照、进出口经营权证明、医疗器械经营许可证(如适用)等。
-
产品技术资料:详细的产品说明书、技术规格书、设计图纸、生产工艺流程、原材料证明等。
-
检验报告:由具有资质的第三方检测机构出具的产品检验报告,包括生物相容性、无菌性、稳定性等关键指标的测试结果。
-
临床试验数据(如适用):对于涉及医疗用途的产品,需提供在中国或国际公认的医疗机构进行的临床试验报告及伦理审查批件。
-
生产国(地区)上市证明:证明产品已在原产国或地区合法上市销售的相关文件。
五、办理周期与注意事项
-
办理周期:进口骨科手术器械产品备案的办理周期相对较长,具体时间因产品复杂性和审评机构的工作效率而异,建议企业提前规划,预留充足时间。
-
注意事项:
-
密切关注国家医疗器械注册管理政策的变化,及时调整策略以适应政策要求。
-
加强与受理机构的沟通,及时了解审评进度和反馈意见,必要时提供补充资料或进行解释说明。
-
选择专业可靠的代办机构合作,提高办理效率和成功率。
-
确保产品符合中国市场的实际需求,注重产品的安全性和有效性,为患者提供高质量的医疗服务。
六、#热门话题:精准医疗与骨科手术器械的未来发展
在#精准医疗#、#骨科创新#、#医疗器械国际化#等热门话题的推动下,骨科手术器械行业正迎来前所未有的发展机遇。
 联系我们
联系我们
 18210828691
18210828691




