



【案例】办理口镜进口备案攻略:深度剖析流程、资料与周期
在口腔医疗领域,口镜作为医生观察患者口腔内部状况不可或缺的工具,其重要性不言而喻。随着医疗技术的不断进步和全球贸易的日益频繁,进口口镜以其精湛的工艺、清晰的视野和舒适的体验,赢得了国内外市场的广泛赞誉。然而,将这些优质产品引入中国市场,必须通过严格的进口备案流程。本文将以实际案例为基础,结合#口腔医疗技术革新#、#医疗器械进口便利化#等热门话题,为您详细解析办理口镜进口备案的全过程,包括流程、所需资料及预计周期,为您的进口之路提供全方位的指导。
一、定义解析:口镜进口备案的意义
口镜进口备案,是指将国外生产的口镜产品引入中国市场前,必须按照国家药品监督管理局(NMPA)及相关法律法规的规定,通过提交详尽的申请资料,并经历技术审评、质量管理体系评估等多个环节,最终获得产品在中国境内合法销售和使用的许可。这一过程不仅是保障进口口镜产品质量与安全、维护国内口腔医疗市场秩序的必要措施,也是促进口腔医疗技术革新、提升医疗服务水平的重要一环。
二、案例背景:口腔医疗技术革新下的进口热潮
随着口腔医疗技术的不断创新与升级,进口医疗器械在国内市场的应用日益广泛。口镜作为口腔检查的基础工具,其性能与品质直接影响到医生的诊断效率和患者的诊疗体验。因此,越来越多的医疗机构和口腔诊所开始关注并引进进口口镜,以满足日益增长的医疗需求。然而,面对复杂的进口备案流程,如何高效、顺利地完成备案手续,成为了进口商和医疗机构共同面临的挑战。
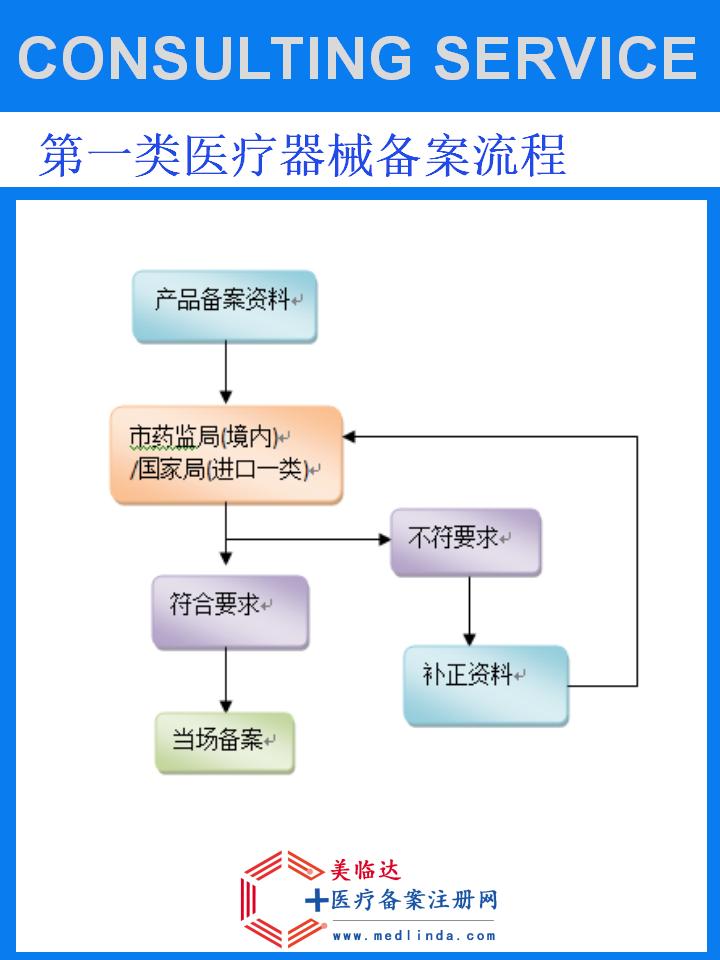
三、办理流程详解
1. 前期准备阶段
-
市场调研:了解国内外口镜市场现状,明确进口需求与产品定位。
-
供应商筛选:选择具有合法资质、产品质量可靠且符合中国市场需求的国外供应商。
-
资料收集与整理:根据NMPA要求,准备包括产品说明书、技术规格书、生产国(地区)上市证明、产品检验报告、质量管理体系文件等在内的详尽资料。
-
法规学习:深入学习NMPA关于进口医疗器械的最新政策法规,确保备案过程合规。
2. 申请提交阶段
-
在线注册:通过NMPA指定的医疗器械注册管理系统提交电子申请,并上传准备好的资料。
-
资料预审:NMPA对提交的申请资料进行初步审核,确认资料的完整性和合规性。
-
补充完善:根据预审反馈,及时补充或修改申请资料,确保无误。
3. 审评与核查阶段
-
技术审评:NMPA组织专家对申请资料进行技术审评,评估产品的安全性、有效性和合规性。
-
现场核查(如适用):对于高风险或特殊产品,NMPA可能要求进行生产现场或质量管理体系的核查。
4. 审批发证阶段
-
审批决定:基于审评和核查结果,NMPA作出是否准予备案的决定。
-
颁发凭证:对于通过审批的产品,NMPA将颁发《医疗器械注册证》及《医疗器械进口备案凭证》,允许其在中国境内合法销售和使用。
四、所需资料概览
-
企业资质证明:进口商及生产企业的营业执照、医疗器械经营许可证等。
-
产品资料:产品说明书、技术规格书、产品标准、生产工艺流程图、产品标签及中文译本等。
-
质量管理体系文件:ISO 13485质量管理体系认证证书、质量控制文件、风险评估报告等。
-
临床评价资料(如适用):临床试验报告或同类产品对比资料。
-
其他:生产国(地区)上市证明、产品包装样图、售后服务承诺书等。
五、预计周期分析
办理口镜进口备案的周期受多种因素影响,包括申请资料的准备情况、产品特性的复杂程度、审评过程中的补充要求以及政策变动等。一般来说,从提交申请到获得备案凭证,整个流程可能需要数月至半年不等的时间。因此,建议进口商提前规划,预留足够的时间以确保备案工作的顺利进行。
六、注意事项与策略建议
-
紧跟政策变化:密切关注NMPA及相关部门发布的最新政策与法规,及时调整备案策略。
-
强化资料准备:确保申请资料的完整性、准确性和合规性,避免因资料不全或错误导致审评延误。
-
加强沟通协作:与供应商、国内代理商及NMPA保持密切沟通,及时解决备案过程中遇到的问题。
-
考虑专业代办:委托具有丰富经验和专业知识的代办机构办理进口备案手续,以提高效率和成功率。
七、结语
在#口腔医疗技术革新#和#医疗器械进口便利化#的浪潮下,办理口镜进口备案不仅是进口商进入中国市场的重要一步,更是促进口腔医疗技术交流与合作的桥梁。
 联系我们
联系我们
 18210828691
18210828691




