 联系我们
联系我们
 18210828691
18210828691







【图文】牙科口外研磨材料一类医疗器械备案要求一览:合规指引,保障品质
#牙科口外研磨材料备案# #一类医疗器械要求# #品质保障#
在医疗器械行业中,牙科口外研磨材料作为一类重要的辅助工具,对于口腔健康的治疗和护理起着不可或缺的作用。为确保牙科口外研磨材料的质量和安全,符合国家监管要求,进行一类医疗器械备案成为了必要的步骤。本文将为您详细梳理牙科口外研磨材料一类医疗器械备案的要求,助您轻松理解并满足相关法规,保障产品品质。
一、牙科口外研磨材料一类医疗器械备案的定义
牙科口外研磨材料一类医疗器械备案,是指按照国家药品监督管理局(NMPA)的规定,对牙科口外研磨材料产品进行的备案登记。通过备案,企业可以确保其生产的牙科口外研磨材料符合一类医疗器械的标准和要求,进而在市场上合法销售和使用。
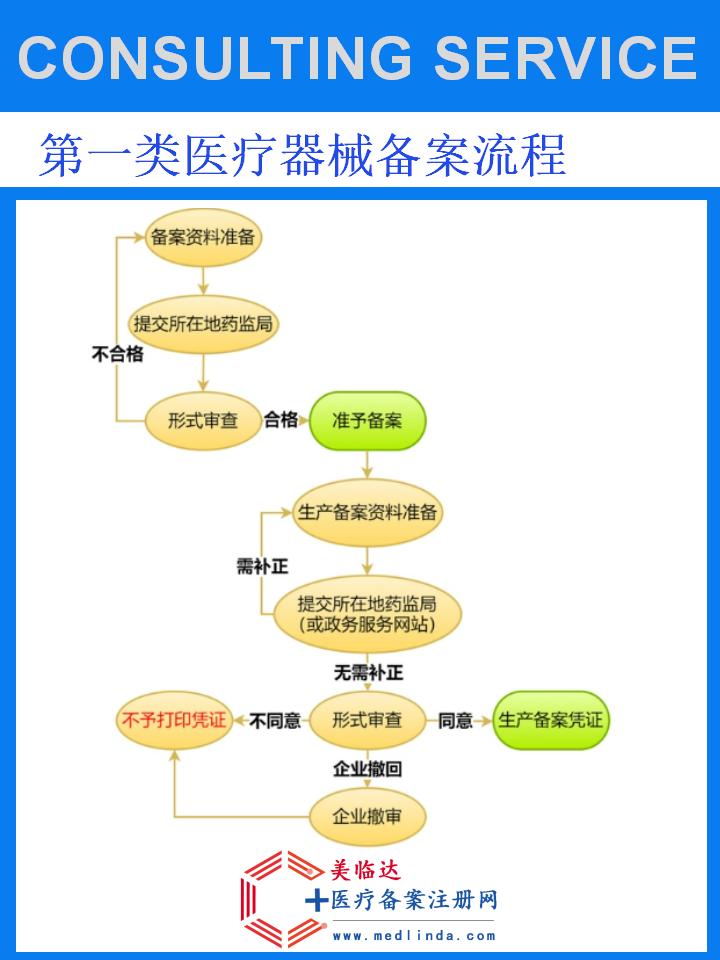
二、牙科口外研磨材料一类医疗器械备案要求
三、总结
牙科口外研磨材料一类医疗器械备案是确保产品质量和安全性的重要环节。通过了解并满足备案要求,企业可以确保产品符合国家标准和行业要求,进而在市场上获得更好的声誉和竞争力。同时,这也是对消费者口腔健康负责的表现。希望本文能为您的牙科口外研磨材料一类医疗器械备案提供有益的参考。