 联系我们
联系我们
 18210828691
18210828691


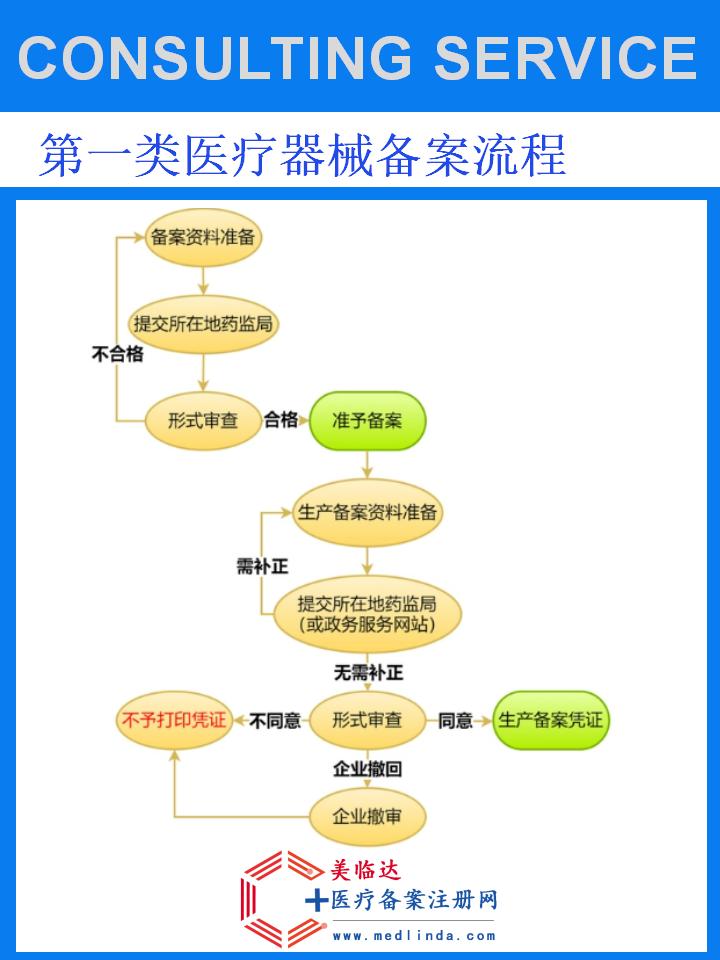





【图文】固定带医械备案办理流程
在医疗行业中,固定带作为一种重要的辅助医疗器具,广泛应用于各类骨折、扭伤等损伤的治疗与康复过程中。为了确保市场上销售的固定带符合医疗器械的严格标准和规定,生产企业必须完成医械备案流程。本文将为您详细介绍固定带医械备案的办理流程,帮助您更好地理解并顺利获得这一重要资质。
#热门话题# 固定带:稳固医疗,守护健康
一、医械备案定义
医械备案是指医疗器械生产企业在产品上市前,按照国家相关法规和标准要求,向医疗器械监管部门提交产品注册申请,经过审核并获得市场准入资格的过程。对于固定带等医疗器械产品而言,医械备案是确保其质量、安全性和有效性的重要保障。
二、固定带医械备案办理流程
在启动医械备案流程前,企业需要深入了解国家关于医疗器械的法规和标准,特别是针对固定带的具体要求。这包括了解产品的分类、技术要求、临床试验等方面的规定,确保产品符合相关要求。
根据法规要求,企业需要准备以下申请材料:
企业将准备好的申请材料提交至当地医疗器械监管部门,并缴纳相应的申请费用。监管部门将对申请材料进行初步审核,确认材料齐全、符合要求后,受理企业的申请。
监管部门将组织专家对企业的申请材料进行技术审评,评估固定带的性能、质量、安全性等方面是否符合要求。如有需要,监管部门还可能进行现场核查或要求企业补充材料。
经过技术审评和现场核查(如有),监管部门将向符合要求的企业颁发固定带医械备案凭证。企业凭此凭证即可在市场上合法销售固定带产品。
三、结语
固定带医械备案办理流程虽然繁琐,但它是确保产品合规性、保障用户健康权益的必要步骤。通过本文的介绍,希望能帮助您更好地了解这一流程,为您的企业在医疗行业中的稳健发展提供有力支持。让我们携手努力,共同为医疗行业的繁荣和健康做出贡献!