 联系我们
联系我们
 18210828691
18210828691







【图文】一次性使用口镜:分类界定与备案指南
在口腔医疗领域,每一次细致入微的检查都离不开专业工具的辅助,其中一次性使用口镜作为保障医患双方安全的重要器械,其地位不言而喻。随着#医疗安全与卫生防护#成为公众关注的焦点,了解一次性使用口镜的医疗器械分类及备案流程显得尤为重要。本文将为您详细解析这一关键信息,助您轻松掌握合规要点。
一次性使用口镜,顾名思义,是专为单次诊疗设计,使用后即丢弃的口腔检查工具。它通常由手柄、反光镜等部分组成,用于口腔内部结构的观察与诊断。根据《医疗器械分类规则》,一次性使用口镜因其用途和潜在风险,通常被归类为一类医疗器械。一类医疗器械是指通过常规管理足以保证其安全性、有效性的医疗器械,其风险程度相对较低,但仍需进行备案管理。
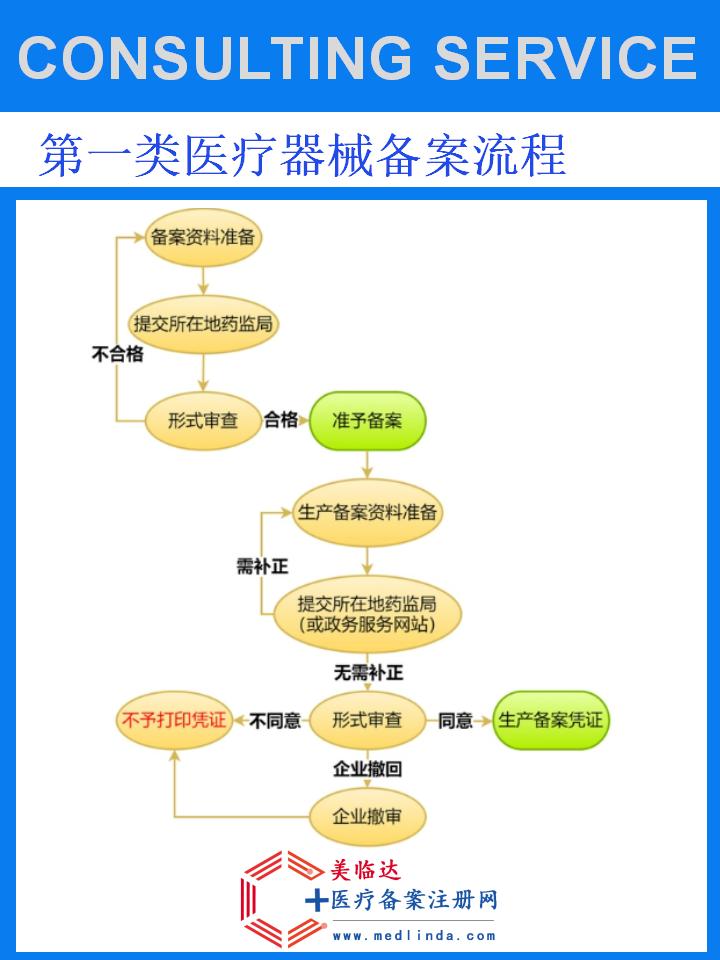
首先,生产企业需具备合法的医疗器械生产资质,包括营业执照、生产许可证等。同时,应建立健全的质量管理体系,确保产品质量可控。
准备完整的产品技术资料,包括但不限于产品设计图纸、生产工艺流程、原材料证明、质量检测报告等。这些资料需真实、准确,能够充分反映产品的安全性、有效性及合规性。
将准备好的资料提交至所在地省级药品监督管理部门或国家药品监督管理局指定的在线平台。提交时,需按照要求填写相关表格,确保信息无误。
监管部门将对提交的备案申请进行形式审查,必要时可能进行现场核查或抽样检验。审核通过后,产品信息将在国家药品监督管理局网站公示,供公众查询。
公示无异议后,生产企业将获得一次性使用口镜的备案凭证。此凭证是产品合法上市销售的重要依据,企业应妥善保管并妥善使用。
一次性使用口镜作为口腔医疗中的基础工具,其合规生产与备案对于保障医疗安全与卫生防护至关重要。通过遵循上述分类界定与备案流程,生产企业不仅能够顺利获得备案凭证,还能在市场中树立合规、专业的品牌形象。在#医疗安全与卫生防护#的大背景下,让我们共同努力,为医患双方提供更加安全、高效的诊疗环境。